恶性程度高,手术难以彻底切除,术后容易早期复发和转移是神经内分泌癌的生物学行为特点。由于此类肿瘤罕见,尚无标准的治疗方案。大多数文献推荐参考小细胞肺癌的治疗模式,然而效果并不理想。近期我科对一例复发转移的肾脏神经内分泌癌采用免疫联合抗血管生成治疗,疗效显著。
患者程XX,男,54岁。2018年11月,因“渐进性左侧腰痛加重2月”就诊,CT提示左侧腹膜后、左侧肾实质及肾门多发占位。住院行“左肾根治性切除+淋巴结清扫术”,术后病理:肾脏小细胞神经内分泌癌,肿块直径为9cm,癌组织侵犯肾盂、肾窦及肾周脂肪组织,脉管、神经见癌组织侵犯。肾门周围融合性淋巴结见癌转移,腹主动脉旁纤维组织癌浸润。术后一月就诊于我科,发现已出现锁骨上淋巴结转移。在给予三周期EP方案化疗后,肿瘤退缩不明显,并于2019年4月出现颅骨转移。我科给以颅骨局部放疗同时更换二线化疗方案为“替莫唑胺+卡培他滨”,颅骨局部转移灶控制,但仅仅过了两月(2019年6月),又出现原左肾手术区肿瘤复发,腹膜后多发淋巴结转移和多发椎骨转移。此时患者状况已经相对较差,对于二线化疗失败后的神经内分泌癌,国际上也没有肯定的治疗方案,国内仅少数文献报道抗血管生成靶向治疗可能有效,且有效率很低。为减轻患者局部复发病灶局部症状,我科再次针对于腹腔内复发病灶和骨转移灶姑息放疗并同时试用阿帕替尼抗血管生成治疗。虽然经过放疗,复发病灶病灶得以控制,但仅过一月后,患者就又再度出现了肝转移。这似乎说明,抗血管生成治疗对控制转移也无效,系统性治疗已到了无药可用的山穷水尽地步。此时,科室对于该患者的下一步处理,进行了科内讨论。最终,在基于对此类肿瘤病理学的深入研究,神经内分泌癌表现为较多淋巴细胞浸润和PD-L1表达,提示这类肿瘤可能从PD-1单抗治疗中获益。在参考其他肿瘤免疫治疗的成功经验后,同时个体化兼顾到患者当时身体状况难以耐受化疗,2019年8月份我科制定了下一步的治疗方案,继续保留副作用较小的阿帕替尼同时联合免疫检查点抑制剂特瑞普利单抗(PD-1单抗)治疗。仅仅给予了3周期的免疫联合抗血管靶向生成治疗(后因经济条件未继续治疗),患者肿瘤病灶几乎完全缓解,并持续起效。2020年3月,患者来我科复查,身体状况恢复正常, CT提示肝脏转移瘤完全消失,其他部位转移灶也继续保持接近完全缓解状态。
对于晚期神经内分泌癌的治疗,目前大多数单位一线方案是参考小细胞肺癌的含铂化疗。二线治疗方案包括替莫唑胺联合卡培他滨或FOLFIRI方案或FOLFOX方案,但未形成统一的共识,二线治疗中位生存期不足6个月。国内首个采用免疫治疗既往化疗失败的神经内分泌癌的临床试验,是来自2020年2月24日北京大学肿瘤医院在Clinical Cancer Research期刊上的一项Ⅰb期研究报道,然而研究数据显示在非选择人群总有效率也仅仅只有20%。所以,对于此类晚期罕见肿瘤治疗方案没有高级别的循证证据采纳,更多是基于医生的经验和基础理论上的推断来制定方案。而抗血管生成靶向药物可以降低髓源性抑制细胞和调节性T细胞的活性,阻断VEGF介导的对树突状细胞成熟的抑制,使得结合肿瘤抗原的T细胞更有效地启动和活化,正常化肿瘤血管结构,促进T细胞浸润进入肿瘤,重塑肿瘤微环境,肿瘤组织从免疫抑制改变为免疫许可模式,从而发挥其与免疫治疗的协同作用。我科选择抗血管生成联合免疫治疗,也正是基于这一基础理论的考虑。
该患者是一例高度恶性的局部晚期罕见肿瘤,运用多种治疗手段经多线治疗后取得突破,转危为安,接近达到无瘤生存,体现了我院解决疑难肿瘤治疗的实力。同时也提示,对于晚期罕见疑难肿瘤,基于基础理论推断的临床尝试有时也能给患者带来新的希望。
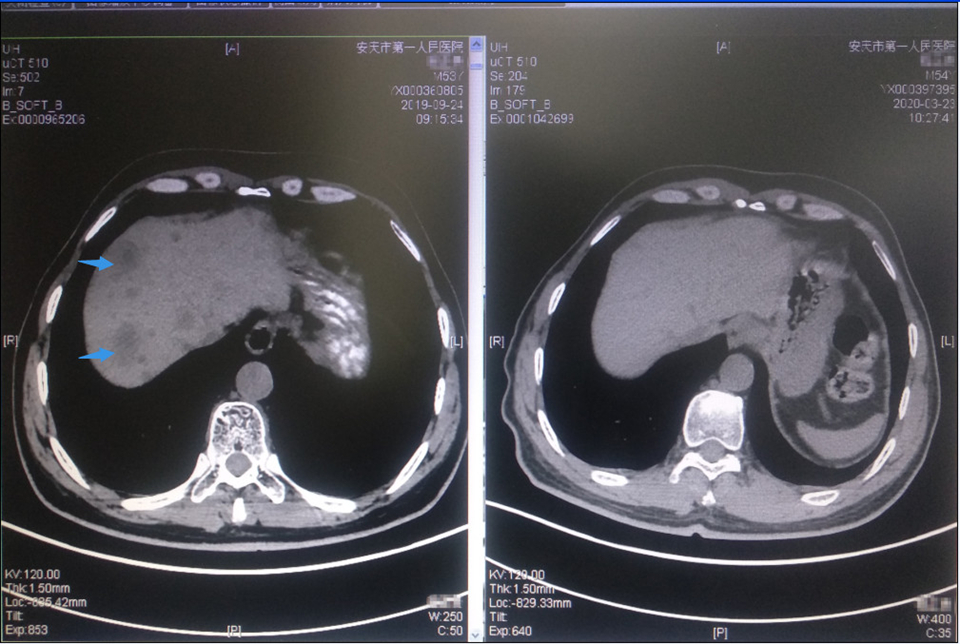
 (免疫联合抗血管生成靶向后:箭头示多发肝转移灶消失)
(免疫联合抗血管生成靶向后:箭头示多发肝转移灶消失)


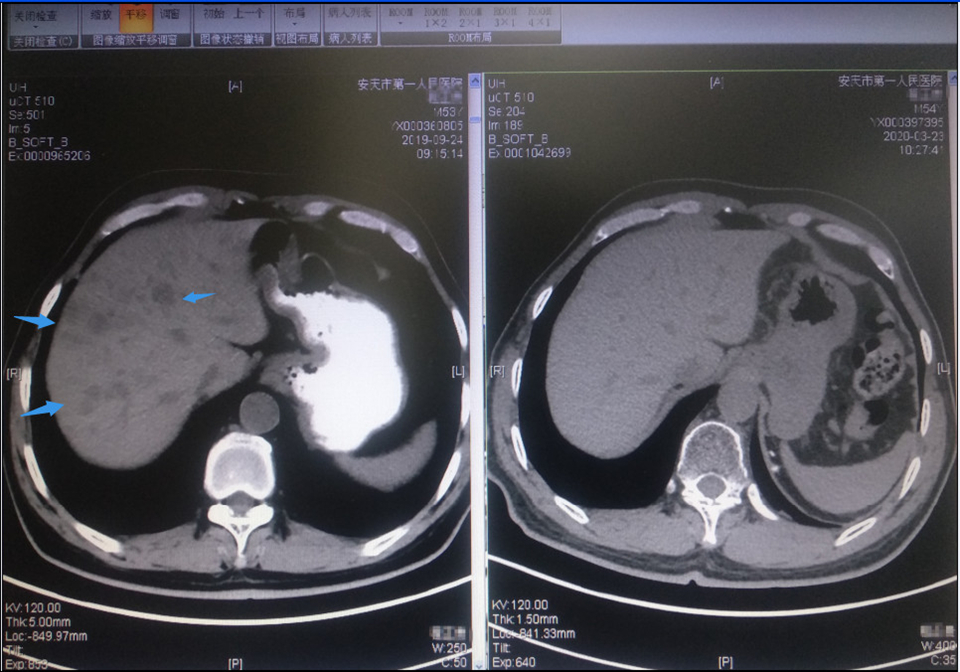
 (免疫联合抗血管生成靶向后:箭头示多发肝转移灶消失)
(免疫联合抗血管生成靶向后:箭头示多发肝转移灶消失)
 微信公众号
微信公众号